anwendungsgebiet(e)
behandlung Eines Floh- (ctenocephalides Spp.) und Zeckenbefalls
(dermacentor Reticulatus). Das Tierarzneimittel Hat Eine
persistierende Insektizide Wirkung von Bis Zu 5 Wochen Gegen Flöhe
(ctenocephalides Felis). Das Tierarzneimittel Hat Eine
persistierende Akarizide Wirkung von Bis Zu 2 Wochen Gegen Zecken
(rhipicephalus Sanguineus, Ixodes Ricinus, Dermacentor
reticulatus). Bei Bestimmten Zeckenarten (rhipicephalus Sanguineus
und Ixodes Ricinus) Werden Möglicherweise Nicht Alle Zecken
innerhalb Der Ersten 48 Stunden Nach Dem Auftragen Abgetötet,
sondern Erst Innerhalb Einer Woche. Das Tierarzneimittel Kann Als
teil Eines Behandlungsplans zur Kontrolle Der
flohallergiedermatitis (fad) Verwendet Werden, Sofern Dies Zuvor
durch Einen Tierarzt Diagnostiziert Wurde.
Pflichtangaben
Über Wirkung und Mögliche Unerwünschte Wirkungen Informieren gebrauchsinformation, Tierarzt, Oder Apotheker.
Gebrauchsinformation
Bei uns haben Sie die Möglichkeit, rezeptfreie Arzneimittel und viele weitere Apotheken-Produkte bequem und sicher über das Internet zu bestellen. Unsere erfahrenen Apothekerinnen und Apotheker stehen Ihnen für entsprechende Beratungen gerne zur Verfügung – sei es per Telefon, E-Mail oder persönlich vor Ort.
Für einen sicheren Online-Einkauf von Medikamenten – begleitet von persönlicher, fachkundiger Beratung und höchster Produktqualität aus Ihrer österreichischen Apotheke.
1. Bezeichnung des Tierarzneimittels
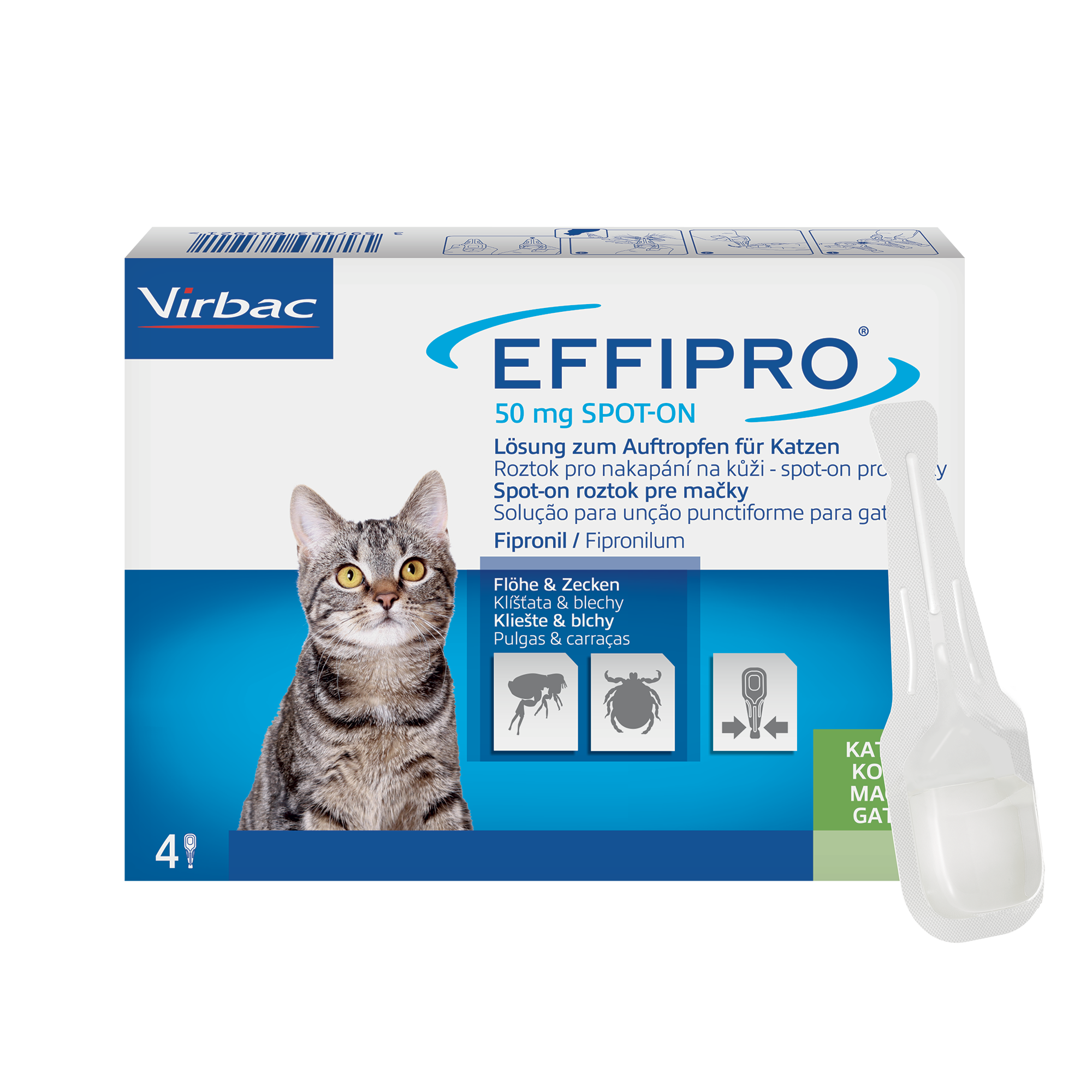
Effipro 50 mg Lösung zum Auftropfen für Katzen
2. Zusammensetzung
Eine 0,5 ml Pipette enthält:
Wirkstoff:
Fipronil
50 mg
Sonstige Bestandteile:
Butylhydroxyanisol (E320)
0,10 mg
Butylhydroxytoluol (E321)
0,05 mg
Klare, farblose bis gelbliche Lösung zum Auftropfen.
3. Zieltierart(en)
Katze.
4. Anwendungsgebiet(e)
Behandlung eines Floh- (Ctenocephalides spp.) und Zeckenbefalls (Dermacentor reticulatus).
Das Tierarzneimittel hat eine persistierende insektizide Wirkung von bis zu 5 Wochen gegen Flöhe
(Ctenocephalides felis).
Das Tierarzneimittel hat eine persistierende akarizide Wirkung von bis zu 2 Wochen gegen Zecken
(Rhipicephalus sanguineus, Ixodes ricinus,Dermacentor reticulatus). Bei bestimmten Zeckenarten
(Rhipicephalus sanguineus und Ixodes ricinus) werden möglicherweise nicht alle Zecken innerhalb der
ersten 48 Stunden nach dem Auftragen abgetötet, sondern erst innerhalb einer Woche.
Das Tierarzneimittel kann als Teil eines Behandlungsplans zur Kontrolle der Flohallergiedermatitis
(FAD) verwendet werden, sofern dies zuvor durch einen Tierarzt diagnostiziert wurde.
5. Gegenanzeigen
Aufgrund fehlender Daten wird empfohlen, das Tierarzneimittel nicht bei Katzenwelpen anzuwenden,
die jünger als 2 Monate und/oder leichter als 1 kg Gewicht sind.
Nicht anwenden bei erkrankten (systemische Krankheiten, Fieber…) oder genesenden Tieren.
Nicht anwenden bei Kaninchen, da Nebenwirkungen und sogar Tod die Folge sein können.
Nicht anwenden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile.
6. Besondere Warnhinweise
Besondere Warnhinweise:
Flöhe von Haustieren befallen häufig auch das Körbchen, Lager und Ruheplätze wie Teppiche und
Polstermöbel. Bei intensivem Befall und zu Beginn der Bekämpfungsmaßnahme sollten daher diese
Plätze mit einem geeigneten Insektizid behandelt und regelmäßig abgesaugt werden.
Das Tierarzneimittel verhindert nicht, dass einzelne Zecken das Tier befallen. Wenn das Tier vor dem
Zeckenbefall behandelt wurde, werden diese Zecken in den ersten 24-48 Stunden abgetötet. Die
Abtötung erfolgt üblicherweise vor dem Vollsaugen, so dass das Risiko einer durch Zecken
übertragbaren Krankheit dadurch reduziert, aber nicht vollständig ausgeschlossen werden kann. Sobald
die Zecken abgetötet sind, fallen sie im Allgemeinen vom Tier ab, verbleibende Zecken können mit
sanftem Zug entfernt werden.
Vermeiden Sie häufiges Baden oder Schamponieren, da keine Daten zum Einfluss von
Baden/Schamponieren auf die Wirksamkeit des Tierarzneimittels zur Verfügung stehen.
Als Teil eines Behandlungsplanes gegen Flohallergiedermatitis werden monatliche Anwendungen für
das allergische Tier und andere im Haushalt lebende Katzen empfohlen.
Zur optimalen Bekämpfung des Flohproblems in einem Haushalt mit mehreren Tieren sollten alle
Hunde und Katzen mit einem geeigneten Insektizid behandelt werden.
Besondere Vorsichtsmaßnahmen für die sichere Anwendung bei den Zieltierarten:
Kontakt mit den Augen des Tieres vermeiden. Wenn das Tierarzneimittel versehentlich in die Augen
gelangt, müssen diese sofort und gründlich mit Wasser gespült werden.
Das Tierarzneimittel nicht auf Wunden oder Hautläsionen anwenden.
Besondere Vorsichtsmaßnahmen für den Anwender:
Dieses Tierarzneimittel kann Reizungen der Schleimhaut und der Augen verursachen. Daher sollte der
Kontakt mit Mund oder Augen vermieden werden.
Wenn das Tierarzneimittel versehentlich in die Augen gelangt, müssen diese sofort und gründlich mit
Wasser gespült werden. Wenn die Augenreizung bestehen bleibt, ist unverzüglich ein Arzt zu Rate zu
ziehen und die Packungsbeilage oder das Etikett vorzuzeigen.
Vermeiden Sie den Kontakt mit den Händen. Wenn das Tierarzneimittel versehentlich auf die Haut
gelangt, muss diese mit Wasser und Seife gewaschen werden.
Nach der Anwendung Hände waschen.
Während der Anwendung nicht essen, trinken oder rauchen.
Personen mit bekannter Überempfindlichkeit gegen Fipronil oder einen der sonstigen Bestandteile
sollten den Kontakt mit dem Tierarzneimittel vermeiden.
Vermeiden Sie den direkten Kontakt mit der Applikationsstelle, solange diese noch feucht ist. Kinder
sind während dieser Zeit vom behandelten Tier fernzuhalten. Es wird daher empfohlen, Tiere nicht
während des Tages sondern am frühen Abend zu behandeln. Darüber hinaus sollten frisch behandelte
Tiere nicht bei den Besitzern, insbesondere Kindern, schlafen.
Sonstige Vorsichtsmaßnahmen:
Die alkoholische Trägerlösung kann bestimmte Materialien, z. B. bemalte, lackierte oder andere
Oberflächen oder Möbel angreifen.
Trächtigkeit und Laktation:
Laboruntersuchungen an Katzen ergaben keine Hinweise auf teratogene oder embryotoxische
Wirkungen. Es wurden keine Studien mit diesem Tierarzneimittel bei tragenden und säugenden Katzen
durchgeführt. Nur anwenden nach entsprechender Nutzen-Risiko-Bewertung durch den behandelnden
Tierarzt.
Überdosierung:
In Verträglichkeitsstudien an Katzen und Katzenwelpen im Alter von 2 Monaten und älter mit einem
Gewicht von ca. 1 kg wurden nach Anwendung der fünffachen empfohlenen Dosis (tägliche
therapeutische Dosis, die an fünf aufeinander folgenden Tagen angewendet wurde) in drei aufeinander
folgenden Monaten außer Juckreiz und einmalig aufgetretenem Erbrechen keine Nebenwirkungen
beobachtet. Das Risiko von Nebenwirkungen kann im Falle einer Überdosis steigen.
7. Nebenwirkungen
Katze:
Sehr selten (< 1 Tier/10 000 behandelte Tiere, einschließlich Einzelfallberichte):
Reaktion an der Applikationsstelle1 (schuppige Haut, Alopezie (Haarausfall), Pruritus (Juckreiz),
Erythem (Hautrötung))
generalisierter Juckreiz, generalisierte Alopezie
Hypersalivation2 (Vermehrter Speichelfluss)
Neurologische Störung3 (Hyperästhesie (Überempfindlichkeit für Reize), Dämpfung des
Zentralnervensystems und neurologische Symptome)
Erbrechen
1Vorübergehende Hautreaktionen an der Applikationsstelle
2Wenn das Tier die Lösung ableckt, kann für kurze Zeit vermehrter Speichelfluss durch die
Trägerlösung auftreten.
3Reversible Symptome
Die Meldung von Nebenwirkungen ist wichtig. Sie ermöglicht die kontinuierliche Überwachung der
Verträglichkeit eines Tierarzneimittels. Falls Sie Nebenwirkungen, insbesondere solche, die nicht in
der Packungsbeilage aufgeführt sind, bei Ihrem Tier feststellen, oder falls Sie vermuten, dass das
Tierarzneimittel nicht gewirkt hat, teilen Sie dies bitte zuerst Ihrem Tierarzt mit. Sie können
Nebenwirkungen auch an den Zulassungsinhaber oder den örtlichen Vertreter des Zulassungsinhabers
unter Verwendung der Kontaktdaten am Ende dieser Packungsbeilage oder über Ihr nationales
Meldesystem melden.
DE: Die Meldungen sind vorzugsweise durch einen Tierarzt an das Bundesamt für Verbraucherschutz
und Lebensmittelsicherheit (BVL) zu senden. Meldebögen und Kontaktdaten des BVL sind auf der
Internetseite https://www.vet-uaw.de/ zu finden oder können per E-Mail (uaw@bvl.bund.de)
angefordert werden. Für Tierärzte besteht die Möglichkeit der elektronischen Meldung auf der oben
genannten Internetseite.
AT: Bundesamt für Sicherheit im Gesundheitswesen, Traisengasse 5, AT-1200 WIEN
E-Mail: basg-v-phv@basg.gv.at, Website: https://www.basg.gv.at/
8. Dosierung für jede Tierart, Art und Dauer der Anwendung
Art der Anwendung und Dosierung:
Nur zur äußerlichen Anwendung.
Lokale Anwendung auf die Haut 1 Pipette mit 0,5 ml pro Tier.
Verabreichungsform:
Thermogeformte Pipetten:
Halten Sie die Pipette senkrecht. Klopfen Sie an dem engen Teil der Pipette, damit sich der komplette
Inhalt im Hauptteil der Pipette befindet. Knicken Sie die Verschlusskappe der Spot-On-Pipette entlang
der markierten Linie ab.
Scheiteln Sie das Fell, so dass die Haut sichtbar wird. Setzen Sie die Pipettenspitze auf die Haut und
drücken Sie die Pipette mehrmals, um den Inhalt direkt auf der Haut zu entleeren. Wiederholen Sie das
Verfahren an einer oder zwei anderen Stellen im Nackenbereich der Katze, bevorzugt an der
Schädelbasis und zwischen den Schultern.
(Anmerkung: Die Form der Pipetten sowie die Abbildungen auf den äußeren
Umhüllungen/Gebrauchsinformationen können differieren.)
Polypropylen-Pipetten:
Nehmen Sie die Pipette aus der Verpackung. Halten Sie die Pipette senkrecht und entfernen Sie die
Verschlusskappe durch Drehen und Abziehen. Drehen Sie die Verschlusskappe herum und setzen Sie
das andere Ende der Kappe zurück auf die Pipette. Drehen Sie die Kappe, um das Siegel zu brechen,
entfernen Sie dann die Kappe von der Pipette.
Scheiteln Sie das Fell, so dass die Haut sichtbar wird. Setzen Sie die Pipettenspitze direkt auf die Haut
und drücken Sie die Pipette mehrmals, um den Inhalt auf der Haut zu entleeren. Wiederholen Sie das
Verfahren an einer oder zwei Stellen im Nackenbereich der Katze, bevorzugt an der Schädelbasis und
zwischen den Schultern.
Es ist darauf zu achten, dass das Tierarzneimittel an einer Stelle aufgetragen wird, an der das Tier es
nicht ablecken kann und dass sich die Tiere nach der Behandlung nicht gegenseitig ablecken.
Das Fell sollte nicht übermäßig durchnässt werden, da dies die Haare an der Applikationsstelle verklebt.
Tritt dies jedoch auf, verschwindet es innerhalb von 24 Stunden nach der Behandlung.
Bis 48 Stunden nach der Behandlung können weißliche Lösungsrückstände erkennbar sein.
(Hinweis: Es gibt zwei innenliegende Beilagen, eine Beilage für jede Art von Pipette. Aus praktischen
Gründen sind beide jedoch auf einer innenliegenden Beilage angegeben.)
9. Hinweise für die richtige Anwendung
Behandlungsplan:
Zur optimalen Beseitigung eines Floh- und/oder Zeckenbefalls kann ein Behandlungsplan entsprechend
den epidemiologischen Gegebenheiten vor Ort erstellt werden.
Da keine diesbezüglichen Verträglichkeitsstudien vorliegen, beträgt die Mindestwartezeit bis zur
nächsten Behandlung 4 Wochen.
10. Wartezeiten
Nicht zutreffend.
11. Besondere Lagerungshinweise
Arzneimittel unzugänglich für Kinder aufbewahren.
Unter 30 C lagern.
Trocken lagern.
Im Originalbehältnis aufbewahren.
Sie dürfen dieses Tierarzneimittel nach dem auf der Pipette angegebenen Verfalldatum nach „Exp.“
nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Erst unmittelbar vor Anwendung aus der Blisterverpackung entfernen.
12. Besondere Vorsichtsmaßnahmen für die Entsorgung
DE: Nicht aufgebrauchte Tierarzneimittel sind vorzugsweise bei Schadstoffsammelstellen abzugeben.
Bei gemeinsamer Entsorgung mit dem Hausmüll ist sicherzustellen, dass kein missbräuchlicher
Zugriff auf diese Abfälle erfolgen kann. Tierarzneimittel dürfen nicht mit dem Abwasser bzw. über die
Kanalisation entsorgt werden. Diese Maßnahmen dienen dem Umweltschutz.
AT: Arzneimittel sollten nicht über das Abwasser oder den Haushaltsabfall entsorgt werden.
Nutzen Sie Rücknahmesysteme für die Entsorgung nicht verwendeter Tierarzneimittel oder daraus
entstandener Abfälle nach den örtlichen Vorschriften und die für das betreffende Tierarzneimittel
geltenden nationalen Sammelsysteme. Diese Maßnahmen dienen dem Umweltschutz.
Das Tierarzneimittel darf nicht in Gewässer gelangen, da es eine Gefahr für Fische und andere
Wasserorganismen darstellen kann.
Teiche, Gewässer oder Bäche dürfen nicht mit dem Tierarzneimittel oder leeren Behältnissen
verunreinigt werden.
Fragen Sie Ihren Tierarzt oder Apotheker, wie nicht mehr benötigte Arzneimittel zu entsorgen sind.
13. Einstufung von Tierarzneimitteln
AT/DE: Tierarzneimittel, das nicht der Verschreibungspflicht unterliegt.
14. Zulassungsnummern und Packungsgrößen
DE: Zul.-Nr.: 401106.00.00
AT : Z.Nr. 8-00799
Thermogeformte Pipetten: Schachtel mit 1, 2, 3, 4, 6, 8, 12, 24, 30, 60, 90 oder 150 Pipetten.
Polypropylen-Pipetten: Blisterkarten oder Schachteln mit 1, 2, 3, 4, 6, 8, 12, 24, 30, 60, 90 oder 150
Pipetten.
Es werden möglicherweise nicht alle Packungsgrößen in Verkehr gebracht.
15. Datum der letzten Überarbeitung der Packungsbeilage
AT: 04/2024
Detaillierte Angaben zu diesem Tierarzneimittel sind in der Produktdatenbank der Europäischen
Union verfügbar (https://medicines.health.europa.eu/veterinary).
16. Kontaktangaben
Zulassungsinhaber und für die Chargenfreigabe verantwortlicher Hersteller:
VIRBAC
1ère avenue 2065m L.I.D
06516 Carros
Frankreich
Örtlicher Vertreter und Kontaktdaten zur Meldung vermuteter Nebenwirkungen:
DE:
VIRBAC Tierarzneimittel GmbH
Rögen 20
DE-23843 Bad Oldesloe
Tel: +49-(4531) 805 111
Mitvertreiber:
VIRBAC Tierarzneimittel GmbH
Rögen 20
DE-23843 Bad Oldesloe
AT:
VIRBAC Österreich GmbH
Hildebrandgasse 27
AT-1180 Wien
Tel: +43-(0)1-218 34 26-0
Falls weitere Informationen über das Tierarzneimittel gewünscht werden, setzen Sie sich bitte mit dem
örtlichen Vertreter des Zulassungsinhabers in Verbindung.
DE: Apothekenpflichtig
AT: Apothekenpflichtig